

关于报告评审方面

网络包括无线、有线网络。 电子数据交换包括单向、双向数据传输。 远程控制包括实时、非实时控制。
产品级关注医疗器械产品自身。 系统级关注医疗信息技术网络。
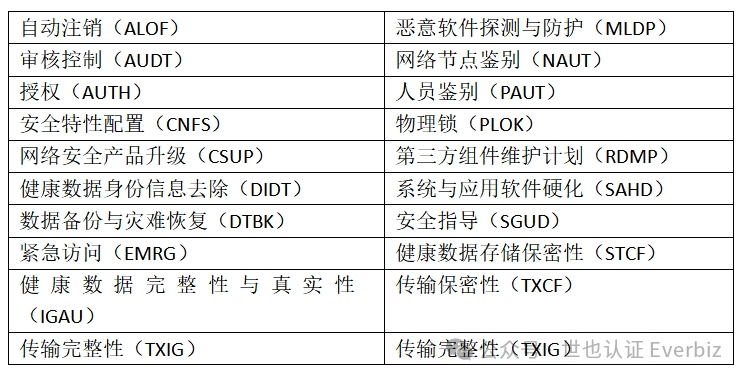
保持医疗器械数据保密性、完整性和可得性。 用户访问控制机制。可采用加密、数字签名、标准协议、校验等技术。 可采用防火墙、入侵检测和恶意代码防护等技术。网络安全能力建设。医疗器械对于网络安全威胁应具备必要的识别、保护能力和适当的探测、响应、恢复能力。 可参考IEC/TR 80001-2-2等标准和技术报告
通过网络(包括无线网络、有线网络)进行电子数据交换或远程控制。考虑网络(如接口、带宽、无线电管理)、数据传输协议(是否为标准协议)、远程控制(是否为实时控制)要求。 通过存储媒介(如光盘、移动硬盘、U盘等)进行电子数据交换,考虑数据储存格式(是否为标准格式)要求。
应用软件指成品软件、遗留软件、外包软件的安全。以及系统软件和支持软件的安全。 应用软件方面重点关注其网络安全问题对医疗器械临床应用的影响。系统软件和支持软件方面重点关注安全补丁更新对医疗器械的影响。
内容包括情况说明、测试计划与报告、新增已知剩余缺陷情况说明。 适用于轻微网络安全更新。

关注产品注册

①单独提交网络安全描述文档
②产品技术要求。含有:
③产品说明书。含有:
END
总之,医疗器械网络安全报告定位方面。网络安全是安全有效性的重要组成部分,网络安全指导原则作为软件指导原则的补充,适用范围略小于软件指导原则。
更多文章阅读:MDR下的产品分类和评估路径
中国 NMPA 注册(二):第一类医疗器械首次备案递交资料全解析
中国 NMPA 注册(三):第二类、第三类医疗器械注册全解析
2025 财年 FDA 官方费用全解析FDA 和 NMPA 电子化提交中的异同点
EN 17161 与 EN 301 549:两者的核心差异与医疗器械的适用性分析
公司介绍 公司地址
公司在中国上海、香港、德国慕尼黑、奥地利萨尔斯堡、泰国设有办公室和分支机构。涉及的合规产品类别有近25个行业(如医疗器械、 新能源、家电、照明、工具、实验室仪器、机械、体外诊断、无线产品、试剂等)。
德国:Landsberger Str.155 80687 München, Germany

